Mechanizm krzepnięcia krwi - ważny przełom w czasach pandemii
Odkrycie przez naukowców mechanizmu krzepnięcia krwi może doprowadzić do opracowania nowych leków przeciwzakrzepowych. Może okazać się to kluczowe, zwłaszcza w czasach pandemii COVID-19.
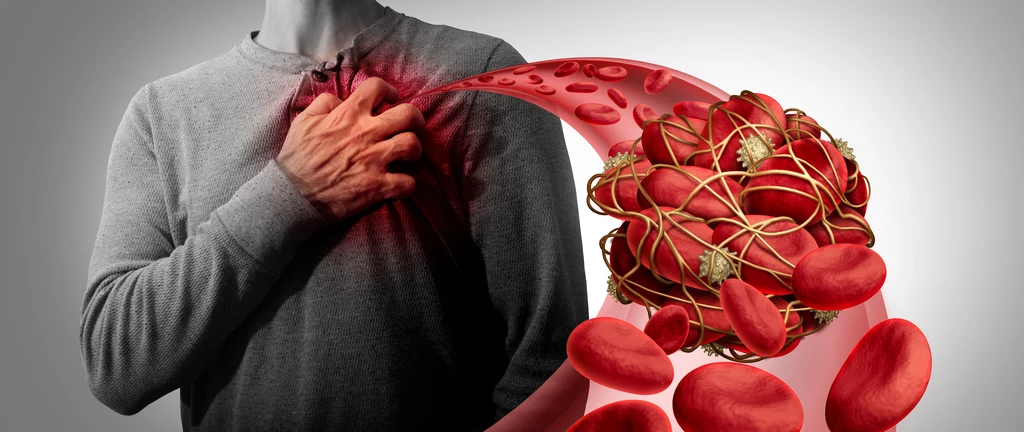
W normalnych warunkach, czynnik von Willebranda (vWF) nie jest angażowany przez nasz organizm. Ta duża i tajemnicza glikoproteina przemieszcza się po krwioobiegu zwinięta w kłębek. Ale kiedy dochodzi do znacznego krwawienia, wkracza do akcji, inicjując proces krzepnięcia.
Gdy vWF działa prawidłowo, pomaga zatrzymać krwawienie i uratować życie. Szacuje się, że co roku w Europie umiera pół miliona osób z powodu zakrzepicy, zaburzenia charakteryzującego się zbyt dużą ilością skrzepów. Zakrzepy krwi mogą wywołać udar mózgu lub zawał serca. Łączono je także z powikłaniami po szczepieniu przeciwko COVID-19.Według prof. X. Franka Zhanga z Wydziału Bioinżynierii Uniwersytetu Lehigh, tylko jeden lek został zatwierdzony przez FDA do celowania w vWF i leczenia zakrzepicy lub nadmiernych zaburzeń krzepnięcia krwi - Caplacizumab. Wiąże się on z vWF i blokuje go przed wiązaniem się z płytkami krwi. Do tej pory jednak naukowcy nie wiedzieli, jaki konkretny mechanizm za tym stoi.Uczeni z Emory University School of Medicine i University of Nottingham pod kierownictwem prof. Zhanga zidentyfikowali specyficzny element strukturalny vWF, który pozwala mu wiązać się z płytkami krwi i inicjować krzepnięcie. Zespół twierdzi, że ta specyficzna jednostka, którą nazywają nieciągłym modułem autoinhibicyjnym (AIM), jest doskonałym miejscem do wiązania leków. - Moduł AIM pozwala cząsteczce vWF pozostać niereaktywną w normalnej krwi krążącej i natychmiast aktywuje vWF w momencie krwawienia. W naszych badaniach zidentyfikowaliśmy, że Caplacizumab działa poprzez wiązanie regionu AIM w vWF i zwiększanie zdolności do mechanicznego usuwania struktur autoinhibicyjnych vWF, co otwiera nową drogę do rozwoju leków przeciwzakrzepowych ukierunkowanych na struktury AIM - powiedział prof. Zhang.Istotną cechą vWF jest to, że pozostaje on niereaktywny wobec płytek krwi przez większość czasu w krążeniu. Jednakże, w miejscach krwawienia, vWF może być aktywowany niemal natychmiast, aby doprowadzić do adhezji płytek krwi i tworzenia się skrzepów. W nowym badaniu zespół zidentyfikował element strukturalny znajdujący się wokół części vWF, zwanej domeną A1, która jest odpowiedzialna za wiązanie płytek krwi.- W normalnej krwi krążącej, AIM owija się wokół A1 i zapobiega interakcji A1 z płytkami krwi. Jednak w miejscu wiązania, zmiana wzorca przepływu krwi prowadzi do wystarczającej siły hydrodynamicznej, aby rozciągnąć AIM i odciągnąć go od A1, umożliwiając A1 przechwytywanie płytek krwi do miejsca krwawienia - dodał prof. Zhang.Naukowcy przed przeprowadzeniem badań podejrzewali, że znajdą moduł autoinhibicyjny, zwłaszcza biorąc pod uwagę wcześniejsze badania. Nie spodziewano się jednak, że region ten odgrywa tak ważną rolę w vWF. Wyniki badań zostały opublikowane w "Nature Communications".