Jeden zastrzyk co dwa miesiące zamiast codziennych tabletek. Przełomowy lek przeciwko HIV
Zamiast codziennej pigułki, zastrzyk co dwa miesiące. Amerykańska Agencja ds. Żywności i Leków (FDA) zatwierdziła przełomowy lek chroniący przed wirusem HIV.
Lek, o którym mowa, nazywa się Apretude i - od strony farmakologicznej - jest to kabotegrawir w postaci zawiesiny do wstrzykiwań o przedłużonym uwalnianiu. Może być stosowany u dorosłych i młodzieży z grupy ryzyka o masie ciała przekraczającej 35 kg w ramach tzw. profilaktyki przedekspozycyjnej (PrEP) zmniejszającej ryzyko zakażenia wirusem HIV drogą płciową. Apretude podaje się w postaci dwóch zastrzyków inicjujących w odstępie jednego miesiąca, a następnie co dwa miesiące.
- Dzisiejsze zatwierdzenie leku stanowi ważne narzędzie w wysiłkach zmierzających do zakończenia epidemii HIV, zapewniając pierwszą opcję zapobiegania HIV, która nie wymaga codziennego przyjmowania tabletek. Ten zastrzyk, podawany co dwa miesiące, będzie miał kluczowe znaczenie dla rozwiązania problemu epidemii HIV w Stanach Zjednoczonych, w tym pomocy osobom wysokiego ryzyka i niektórym grupom, w których przestrzeganie zasad codziennego przyjmowania leków było dużym wyzwaniem - powiedziała Debra Birnkrant, dyrektor Wydziału Leków Przeciwwirusowych w Centrum Oceny i Badań nad Lekami FDA.
Pierwsza taka terapia na rynku
W ostatnich latach poczyniono zauważalne postępy w wykorzystaniu PrEP w profilaktyce HIV w USA. W 2020 r. aż 25 proc. z 1,2 mln Amerykanów z grup ryzyka przyjmowało PrEP, podczas gdy pięć lat wcześniej liczby były zauważalnie mniejsze (zaledwie 3 procent). Nadal jest wiele do poprawy. Istniejące terapie PrEP wymagają regularności do zachowania skuteczności - tabletka musi być przyjmowana codziennie, aby oferować ochronę przed HIV. To spory problem, bo już pominięcie jednej dawki leku, ochronę przed HIV zauważalnie zmniejsza. Stworzenie długotrwałej opcji PrEP przyjmowanej co jakiś czas pod postacią zastrzyku to prawdziwy przełom, który ułatwi życie wielu osobom na świecie.
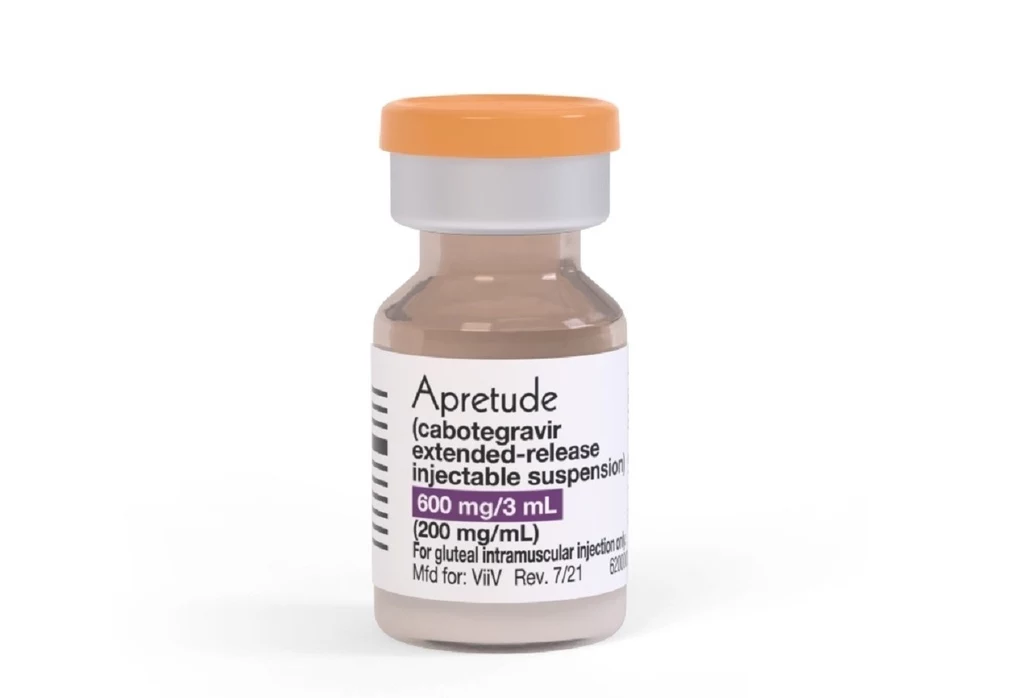
Bezpieczeństwo i skuteczność Apertude w zmniejszeniu ryzyka zakażenia HIV oceniono w dwóch randomizowanych badaniach z podwójnie ślepą próbą (ani pacjent, ani lekarz nie wiedzieli, kto dostawał właściwy lek). Skuteczność Apertude porównano z Truvadą, doustnym lekiem stosowanym raz na dobę w ramach PrEP. W badaniu klinicznym I fazy brali udział 4566 niezakażeni HIV mężczyźni i transseksualne kobiety uprawiające seks z mężczyznami, co wiąże się z wysokim ryzykiem zakażenia HIV. Badania kliniczne II fazy obejmowały niezakażone HIV 3224 kobiety cisgender, narażone na zakażenie HIV.
Grupa otrzymująca Apretude, dostała doustnie tabletkę kabotegrawiru 30 mg i placebo codziennie przez 5 tygodni, a następnie podano im zastrzyk Apretude 600 mg w pierwszym i drugim miesiącu. Procedurę powtarzano co dwa miesiące. Osoby przyjmujące Truvadę przyjmowali lek i placebo codziennie przez 5 tygodni, a następnie doustną Truvadę codziennie i placebo domięśniowo w pierwszym i drugim miesiącu, co powtarzano co dwa miesiące (procedura symulująca podanie Apretude).
Badania fazy I wykazały, że uczestnicy, którzy dostali Apretude byli o 69 proc. mniej narażeni na zakażenie wirusem HIV w porównaniu z grupą kontrolną. W badaniu fazy II skuteczność była jeszcze wyższa, bo wyniosła aż 90 proc. w porównaniu z grupą przyjmującą Truvadę. Odnotowane działania niepożądane były z kategorii łagodnych - reakcja skórna w miejscu wstrzyknięcia, ból głowy, gorączka, zmęczenie, ból pleców, bóle mięśniowe.Warto odnotować, że Apretude jest przeznaczony do użytku tylko wśród osób z negatywnym wynikiem testu na HIV. Nie powinny używać go osoby chore, bo może wywołać niepożądane reakcje. Etykieta leku zawiera również ostrzeżenia dotyczące reakcji nadwrażliwości, hepatotoksyczności (uszkodzenia wątroby) i zaburzeń depresyjnych.FDA przyznała firmie Viiv pozwolenie na dopuszczenie Apretude do obrotu.