Pierwszy wielonarządowy chip do medycyny spersonalizowanej
Naukowcy z Uniwersytetu Columbia stworzyli pierwszy wielonarządowy układ scalony zbudowany z połączonych ludzkich tkanek. Może on pomóc w lepszym modelowaniu chorób ogólnoustrojowych, takich jak nowotwory.
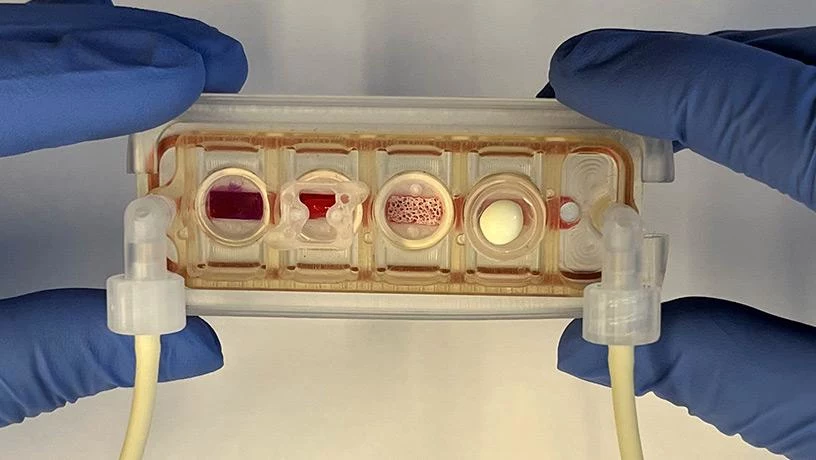
Zmodyfikowane tkanki są kluczowym elementem modelowania chorób oraz testowania skuteczności leków w warunkach laboratoryjnych. Problemem jest konieczność połączenia poszczególnych modułów tkankowych, aby ułatwić ich fizjologiczną komunikację, co jest niezbędne do modelowania warunków obejmujących więcej niż jeden układ narządów, bez uszczerbku dla środowiska poszczególnych tkanek.
Naukowcy z Uniwersytetu Columbia opracowali wielonarządowy chip składający się ze zmodyfikowanych ludzkich tkanek serca, kości, wątroby i skóry, które połączono przepływem naczyiowym z krążącymi komórkami odpornościowymi. Ma on wielkość szkiełka mikroskopowego i można go dostosować do potrzeb pacjenta. Ponieważ przebieg choroby i reakcje na leczenie różnią się znacznie u poszczególnych osób, taki chip umożliwi zindywidualizowaną optymalizację terapii dla każdego pacjenta.
- To dla nas ogromne osiągnięcie - spędziliśmy dziesięć lat na przeprowadzaniu setek eksperymentów, zgłębianiu niezliczonych świetnych pomysłów i budowaniu wielu prototypów, a teraz wreszcie udało nam się opracować platformę, która z powodzeniem oddaje biologię interakcji między organami w organizmie - powiedziała prof. Gordana Vunjak-Novakovic, szefowa projektu badawczego.
Pierwszy taki moduł na świecie
Czerpiąc inspirację z funkcjonowania ludzkiego organizmu, zespół badaczy zbudował ludzki system "tkanki na chipie", w którym połączył dojrzałe moduły tkanek serca, wątroby, kości i skóry poprzez recyrkulację przepływu naczyniowego, umożliwiając komunikację współzależnych organów, tak jak ma to miejsce w ludzkim ciele. Badacze wybrali te tkanki, ponieważ mają one odmienne pochodzenie embrionalne, właściwości strukturalne i funkcjonalne oraz są poddawane negatywnym wpływom leków stosowanych w leczeniu nowotworów, co stanowi rygorystyczny test proponowanego podejścia.
- Ponieważ skupiamy się na wykorzystaniu modeli tkanek pobranych od pacjentów, musimy indywidualnie dojrzewać każdą tkankę, tak aby funkcjonowała w sposób naśladujący reakcje, które można zaobserwować u pacjenta, a nie chcemy rezygnować z tej zaawansowanej funkcjonalności podczas łączenia wielu tkanek. W organizmie każdy narząd utrzymuje swoje własne środowisko, jednocześnie wchodząc w interakcje z innymi narządami dzięki przepływowi naczyniowemu przenoszącemu krążące komórki i czynniki bioaktywne. Dlatego zdecydowaliśmy się połączyć tkanki za pomocą krążenia naczyniowego, zachowując jednocześnie indywidualną niszę tkankową, która jest niezbędna do zachowania wierności biologicznej, naśladując sposób, w jaki nasze organy są połączone w organizmie - wyjaśniła Kacey Ronaldson-Bouchard z zespołu prof. Vunjak-Novakovic.
Uczeni stworzyli moduły tkankowe, każdy w swoim zoptymalizowanym środowisku, a następnie oddzielił je od wspólnego przepływu naczyniowego selektywnie przepuszczalną barierą śródbłonkową. Poszczególne środowiska tkankowe były w stanie komunikować się przez bariery śródbłonkowe i przez krążenie naczyniowe. Badacze wprowadzili również do krążenia naczyniowego monocyty dające początek makrofagom, ze względu na ich ważną rolę w kierowaniu reakcjami tkanek na uraz, chorobę i wyniki leczenia.
Wszystkie tkanki powstały z tej samej linii ludzkich indukowanych pluripotencjalnych komórek macierzystych (iPSC), uzyskanych z niewielkiej próbki krwi, aby zademonstrować możliwość prowadzenia badań zindywidualizowanych, specyficznych dla danego pacjenta. Aby udowodnić, że model ten może być wykorzystywany do badań długoterminowych, zespół utrzymywał tkanki, które były już hodowane i dojrzewały przez 4-6 tygodni, przez kolejne cztery tygodnie, po tym jak zostały połączone perfuzją naczyniową.
Naukowcy chcieli również zademonstrować, w jaki sposób model ten może być wykorzystany do badań nad ważnymi chorobami ogólnoustrojowymi u ludzi i zdecydowali się zbadać niepożądane działanie leków przeciwnowotworowych. Zbadali wpływ doksorubicyny - szeroko stosowanego leku przeciwnowotworowego - na serce, wątrobę, kości, skórę i naczynia krwionośne. Wykazali, że zmierzone efekty odpowiadają efektom opisanym w badaniach klinicznych dotyczących terapii przeciwnowotworowej z użyciem tego samego leku.
Zespół równolegle opracował nowy model obliczeniowy układu wielonarządowego do matematycznej symulacji wchłaniania, dystrybucji, metabolizmu i wydzielania leku. Model ten prawidłowo przewidział metabolizm doksorubicyny do doksorubicynolu i jej dyfuzję do wnętrza chipa. Połączenie wielonarządowego chipa z metodologią obliczeniową w przyszłych badaniach farmakokinetyki i farmakodynamiki innych leków stanowi lepszą podstawę do ekstrapolacji wyników badań przedklinicznych na kliniczne, a tym samym usprawnia proces opracowywania leków.