Wielka tajemnica neurologii rozwiązana. Jak priony niszczą mózg?
Naukowcy ze Scripps Research odkryli sposób, w jaki neurony obumierają w wyniku działania prionów. Proces ten da się zablokować, co może być przydatne również w leczeniu alzheimera i innych chorób neurodegeneracyjnych.
Choroby wywoływane przez priony, jak choroba Creutzfeldta-Jakoba (CJD), to szybko postępujące, śmiertelne zespoły związane z powstawaniem agregatów prionów - PrP. Naukowcy nigdy w pełni nie zrozumieli, jak agregaty te tworzą się i zabijają neurony, ale odkrycia zespołu ze Scripps Research rzucają nowe światło na ten proces. Okazuje się, że priony niszczą neurony poprzez uszkadzanie ich aksonów, czyli wąskich włókien nerwowych wykorzystywanych do komunikacji z innymi neuronami.
Warto wspomnieć, że tworzenie agregatów białkowych w aksonach obserwujemy również w przypadku zaburzeń neurodegeneracyjnych, jak choroba Alzheimera czy Parkinsona. Zrozumienie, jak priony niszczą mózg, może być kluczowe w walce z wymienionymi schorzeniami.
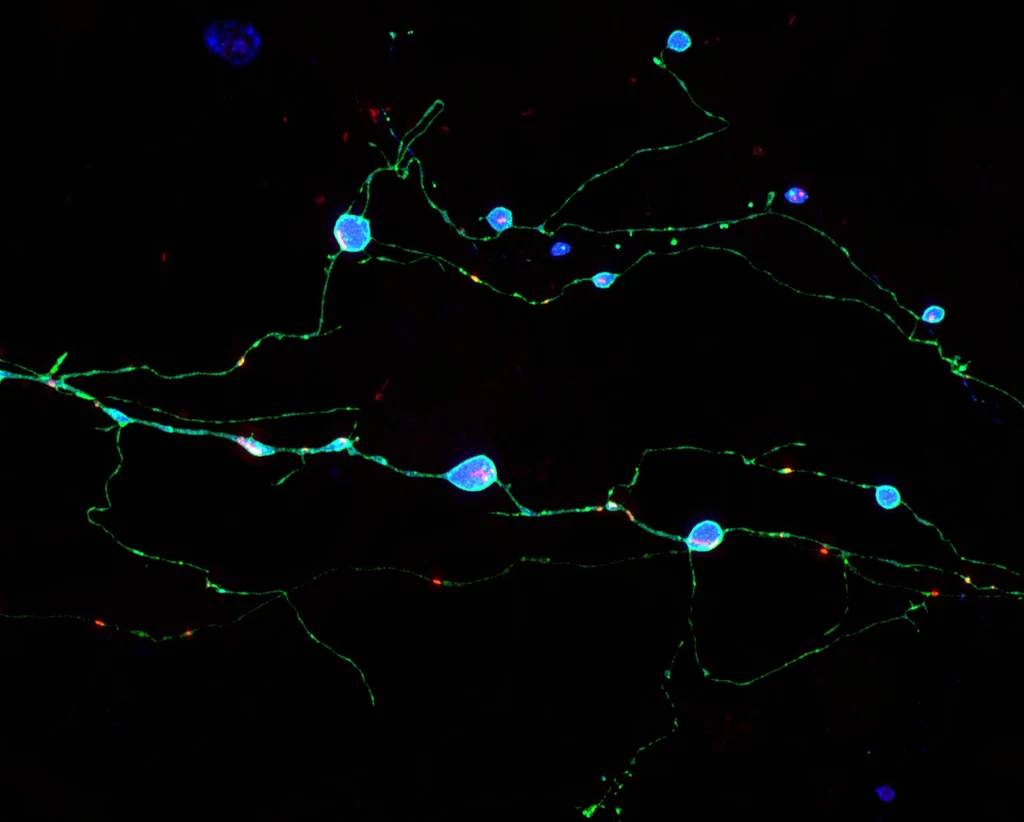
- Mamy nadzieję, że te odkrycia doprowadzą do lepszego zrozumienia chorób prionowych i innych chorób neurodegeneracyjnych, jak również nowych strategii ich leczenia - powiedziała prof. Sandra Encalada ze Scripps Research, główna autorka badań.Naukowcy zaobserwowali jak zmutowane, powodujące chorobę kopie białka PrP tworzą duże agregaty w aksonach, ale nie ciałach neuronów. Po ich utworzeniu, następowały dysfunkcje aksonów, a w końcu śmierć neuronów. Procesy utylizacji odpadów w neuronach są w stanie poradzić sobie z takimi agregatami, gdy znajdują się one w obrębie lub blisko głównych ciał komórkowych neuronów, ale są znacznie mniej skuteczne, gdy agregaty gromadzą się w aksonach.Zidentyfikowano również kompleks kluczowych białek, które odpowiadają za kierowanie PrP do aksonów i powodują ich obrzęk. Wykazano, że wyciszenie któregokolwiek z tych białek powoduje zahamowanie tworzenia się agregatów i chroni neurony przed śmiercią.
Priony pod kontrolą
CJD to najczęstsza choroba prionowa występująca u ludzi. Jest bardzo rzadka - odnotowuje się ok. jeden przypadek na milion osób na całym świecie. Do większości przypadków dochodzi spontanicznie, gdy PrP obecne w mózgu w jakiś sposób zaczynają tworzyć agregaty. W rzadkich przypadkach mogą być one przenoszone między ludźmi, np. podczas przeszczepów rogówki. Około 15 proc. przypadków jest dziedziczonych.Funkcja PrP w neuronach nigdy nie została poznana, ale wydaje się, że białko to jest normalnie wydzielane w trakcie utylizacji odpadów z neuronów. Kiedy mechanizm ten zostanie zaburzony lub PrP zmutuje, tworzą się tzw. endogresomy, których aksony nie mogą się pozbyć. Powstające agregaty prowadzą do obrzęków aksonów i innych oznak dysfunkcji neuronów.
Znaleziono sposób na przeciwdziałanie tworzeniu się endogresomów. Zidentyfikowano cztery białka - Arl8, kinezynę-1, Vps41 i SKIP - które są odpowiedzialne za kierowanie pęcherzyków zawierających PrP do aksonów. Kiedy wyciszono którekolwiek z tych białek, znacznie mniej pęcherzyków zawierających PrP dostało się do aksonów i wykazano niewiele lub żadnych oznak tworzenia agregatów, a neurony funkcjonowały normalnie lub prawie normalnie i przeżywały tak samo dobrze jak normalne komórki mózgowe.Wyniki wskazują na nowe możliwości leczenia chorób prionowych, a być może także chorób neurodegeracyjnych, w których to agregaty białkowe odgrywają ważną rolę.