Nagroda Nobla w dziedzinie fizjologii i medycyny - jak nasze komórki wykrywają poziom tlenu?
Zrozumienie, w jaki sposób organizm reaguje na zmiany stężenia tlenu jest kluczowe do pokonania wielu chorób. Odkrycie to uhonorowano tegoroczną Nagrodą Nobla w dziedzinie fizjologii i medycyny. Co to oznacza dla każdego z nas?
Wszystkie zwierzęta potrzebują tlenu do przekształcenia pokarmu w użyteczną energię. Podstawowa rola tlenu jest znana od wieków, ale sposób, w jaki komórki dostosowują się do zmian środowiskowych, wciąż był owiany tajemnicą. William G. Kaelin Jr., sir Peter J. Ratcliffe i Gregg L. Semeza odkryli, w jaki sposób komórki mogą wykrywać i dostosowywać się do zmieniającej się dostępności tlenu. Naukowcy zidentyfikowali maszynerię molekularną regulującą aktywność genów w odpowiedzi na różne poziomy tlenu. Odkrycie to toruje drogę nowyn strategiom walki z anemią, nowotworami i wieloma innymi chorobami.
Nie ma życia bez tlenu
Tlen w postaci cząsteczkowej stanowi około 1/5 ziemskiej atmosfery. Jest przetwarzany przez mitochondria obecne praktycznie we wszystkich komórkach w celu zamiany pokarmu w użyteczną energię. Otto Warburg, laureat Nagrody Nobla w dziedzinie fizjologii i medycyny z 1931 r., wykazał, że konwersja ta jest procesem enzymatycznym.
Ewolucja wykształciła mechanizmy zapewniające wystarczający dopływ tlenu do tkanek i komórek. Kłębek szyjny, okrągły twór o średnicy 4-6 mm, leżący w rozwidleniu tętnicy szyjnej wspólnej, zawiera wyspecjalizowane komórki, które mają właściwości chemorecepcyjne. Są one wrażliwe na zwiększanie się stężenia dwutlenku węgla (hiperkapnia), spadek ciśnienia tlenu (hipoksemia) oraz kwasicę. Wszystkie te zdarzenia pobudzają kłębek szyjny, stymulując skurcz tętnic, zwolnienie akcji serca oraz hiperwentylację. Za odkrycie pokazujące, w jaki sposób wykrywanie tlenu we krwi przez kłębek szyjny wpływa na nasze oddychanie, Corneille Heymans dostała Nagrodę Nobla w dziedzinie fizjologii i medycyny w 1938 r.
Oprócz szybkiej adaptacji tętnicy szyjnej kontrolowanej przez kłębek szyjny, istnieją inne podstawowe przystosowania fizjologiczne na zmieniające się stężenie tlenu. Kluczową odpowiedzią na niedotlenienie jest wzrost poziomu hormonu znanego jako erytropoetyna (EPO), co prowadzi do zwiększonej produkcji czerwonych krwinek (erytropoeza). Mimo iż znaczenie kontroli hormonalnej erytropoezy było znane już na początku XX wieku, sposób w jaki sam tlen kontroluje ten proces, pozostawał tajemnicą.
Gregg Semenza badał gen EPO i sposób jego regulowania przez różne poziomy tlenu. Wykorzystując myszy ze zmodyfikowanym genem, wykazał, że określone segmenty DNA znajdujące się obok genu EPO pośredniczą w odpowiedzi na niedotlenienie. Sir Peter Ratcliffe także badał zależną od tlenu regulację genu EPO. Oba zespoły niezależnie odkryły, że mechanizm wykrywania tlenu jest obecny praktycznie we wszystkich tkankach, a nie tylko komórkach nerek, gdzie normalnie jest wytwarzana erytropoetyna.

Semenza chciał zidentyfikować składniki komórkowe pośredniczące w tej odpowiedzi. W hodowanych komórkach wątroby odkrył kompleks białkowy, który wiąże się ze zidentyfikowanym wcześniej segmentem DNA w sposób zależny od tlenu. Kompleks ten został nazwany czynnikiem indukowanym przez hipoksję (HIF). Rozpoczęły się prace w celu oczyszczenia kompleksu HIF, a w 1995 r. zespół Semenzy opublikował niektóre ze swoich odkryć. Zidentyfikował także geny kodujące HIF. Stwierdzono, że HIF składa się z dwóch różnych białek wiążących DNA - tzw. czynników transkrypcyjnych - które nazwano HIF-1α i ARNT.
Teraz naukowcy w końcu rozwiązali zagadkę dotyczącą elementów zaangażowanych w te procesy.
Skomplikowana maszyneria
Kiedy poziom tlenu jest wysoki, komórki zawierają bardzo mało HIF-1α, ale gdy poziom tlenu jest niski, ilość HIF-1α wzrasta, aby mógł on wiązać się z genem EPO oraz innymi genami regulującymi ten proces. Kilka grup badawczych wykazało, że HIF-1α, który zwykle ulega szybkiej degradacji, jest chroniony przed tym procesem w warunkach niedotlenienia.
W normalnych warunkach, struktura komórkowa zwana proteasomem, za którą w 2004 r. przyznano Nagrodę Nobla w dziedzinie chemii dla Aarona Ciechanovera, Avrama Hershko i Irwina Rose'a, degraduje HIF-1α. W warunkach niedotlenienia do białka HIF-1α jest dodawany peptyd zwany ubikwityną. Oznacza ona białka przeznaczone do degradacji w proteasomie, tym samym ocalając je od zniszczenia. Nie było jasne, jak ubikwityna wiąże się z HIF-1α w sposób zależny od tlenu.
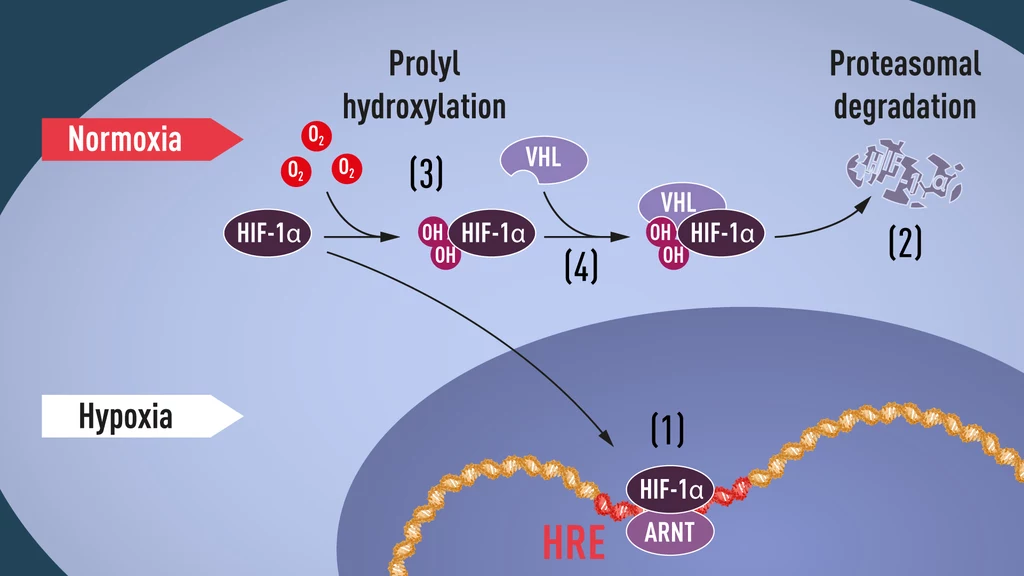
Odpowiedź nadeszła z nieoczekiwanej strony. Mniej więcej w tym samym czasie, gdy Semenza i Ratcliffe badali regulację genu EPO, William Kaelin Jr. studiował mechanizmy dziedzicznej choroby znanej jako zespół von Hippla-Lindaua (VHL). Choroba charakteryzuje się zwiększoną predyspozycją do nowotworów nerek, ośrodkowego układu nerwowego, szczególnie móżdżku, nadnerczy i siatkówki. Wiąże się z mutacją genu supresorowego kodującego białko von Hippla-Lindaua (VHL) na chromosomie 3. Kaelin wykazał, że gen VHL koduje białko zapobiegające wystąpieniu nowotworu. Naukowiec udowodnił także, że komórki rakowe pozbawione funkcjonalnego genu VHL wykazują nienormalnie wysoki poziom genów regulowanych przez hipoksję. Ponowne wprowadzenie genu VHL do komórek przywraca normalne poziomy tlenu. To była ważna wskazówka pokazująca, że VHL jest w jakiś sposób zaangażowany w kontrolowanie odpowiedzi na niedotlenienie.
Dodatkowe sygnały pochodzące z kilku niezależnych grup badawczych sugerowały, że VHL jest częścią kompleksu, który znakuje białka ubikwityną, oznaczając je pod kątem degradacji w proteasomie. Rafcliffe dokonał przełomu i wykazał, że VHL może fizycznie oddziaływać z HIF-1α i jest wymagany do jego degradacji przy normalnym poziomie tlenu.
Naukowcom wciąż brakowało zrozumienia, w jaki sposób poziom tlenu reguluje interakcję między VHL i HIF-1α. Poszukiwania skupiły się na konkretnej części białka HIF-1α, o której wiadomo, że jest ważna dla degradacji zależnej od VHL. Kaelin i Ratcliffe podejrzewali, że klucz do rozwikłania tajemnicy znajduje się gdzieś w tej domenie białkowej. W 2001 r. w dwóch równocześnie opublikowanych artykułach wykazali, że przy normalnym poziomie tlenu, w dwóch określonych pozycjach w HIF-1α są dodawane grupy hydroksylowe. Ta modyfikacja białka zwana jako hydrokslyacja prolinowa pozwala VHL rozpoznawać i wiązać się z HIF-1α. Wyjaśnia to, w jaki sposób normalne poziomy tlenu kontrolują szybką degradację HIF-1α za pomocą enzymów wrażliwych na tlen (tzw. hydroksylaz prolinowych). Naukowcy zidentyfikowali odpowiedzialne za ten proces hydroksylazy prolinowe. Wykazano także, że funkcja aktywująca gen HIF-1α była regulowana przez zależną od tlenu hydroksylację. Laureaci Nagrody Nobla wyjaśnili ten mechanizm.
Na siłowni i podczas nowotworzenia
Dzięki przełomowej pracy tegorocznych laureatów Nagrody Nobla wiemy znacznie więcej o tym, jak różne poziomy tlenu regulują podstawowe procesy fizjologiczne. Wykrywanie tego pierwiastka pozwala komórkom dostosować metabolizm do niskiego poziomu tlenu - choćby w naszych mięśniach podczas intensywnych ćwiczeń na siłowni. Inne przykłady procesów adaptacyjnych kontrolowanych przez wykrywanie tlenu obejmują wytwarzanie nowych naczyń krwionośnych i czerwonych krwinek. Nasz układ odpornościowy jest również modulowany przez maszynerię wykrywającą tlen. Wykazano nawet, że pomiary "pierwiastka życia" są niezbędne w trakcie rozwoju płodowego do kontrolowania prawidłowego tworzenia naczyń krwionośnych i rozwoju łożyska.
Ale wykrywanie tlenu odgrywa także ważną rolę w wielu chorobach. Pacjenci z przewlekłą niewydolnością nerek często cierpią na ciężką anemię z powodu zmniejszonej ekspresji EPO. W guzach nowotworowych mechanizm regulowany tlenem jest wykorzystywany do stymulowania tworzenia naczyń krwionośnych i przekształcania metabolizmu w celu skutecznego namnażania komórek rakowych. W laboratoriach na całym świecie trwają prace nad lekami, które mogą zakłócać różne choroby poprzez aktywację lub blokadę mechanizmów wykrywających tlen.