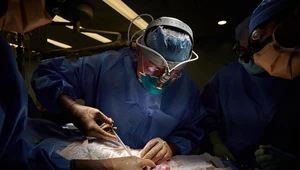
Pierwsza ksenotransplantacja serca u człowieka. Przełom, na który czekaliśmy
Naukowcy z University of Maryland Medical Center poinformowali o przełomie w dziedzinie transplantologii. Jako pierwsi na świecie przeszczepili serce genetycznie zmodyfikowanej świni do ciała człowieka. Zabieg trwał osiem godzin, a 57-letni David Bennett obudził się i oddycha samodzielnie. "Nowe" serce pompuje krew i nie ma śladów odrzucenia organu. Ten przełom w medycynie budzi poważne wątpliwości natury etycznej - czy słusznie?
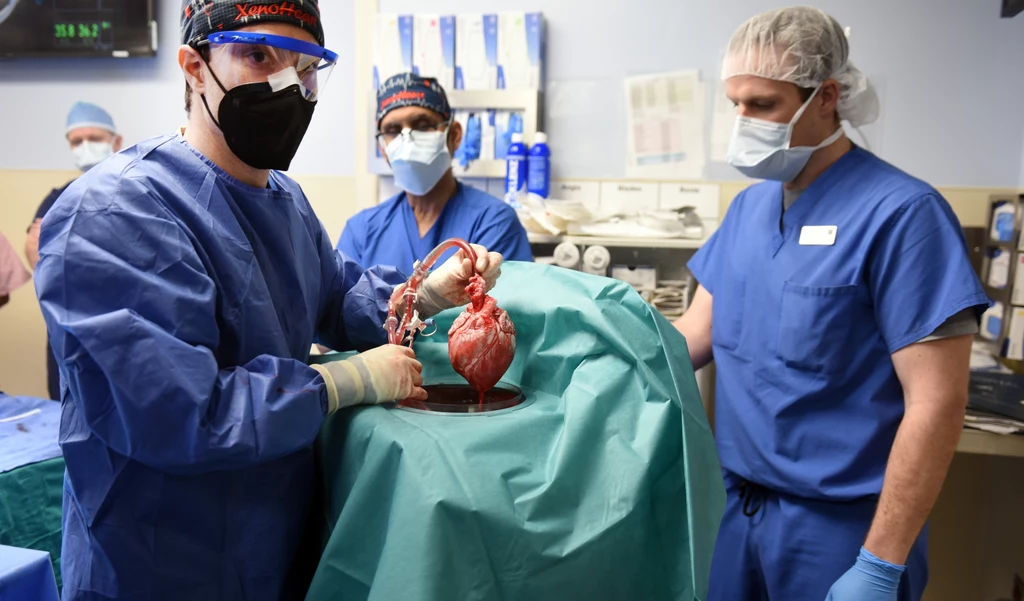
U mężczyzny zdiagnozowano krańcową niewydolność serca, czyli takie stadium niewydolności organu, w którym wszystkie istniejące formy leczenia są niewystarczające. Nie kwalifikował się do przeszczepu serca od martwego dawcy, a także mechanicznego wspomagania pracy tego organu. Jedyną możliwością było zastosowanie eksperymentalnej terapii - ksenotransplantacji, czyli przeszczepu zmodyfikowanego genetycznie świńskiego serca.
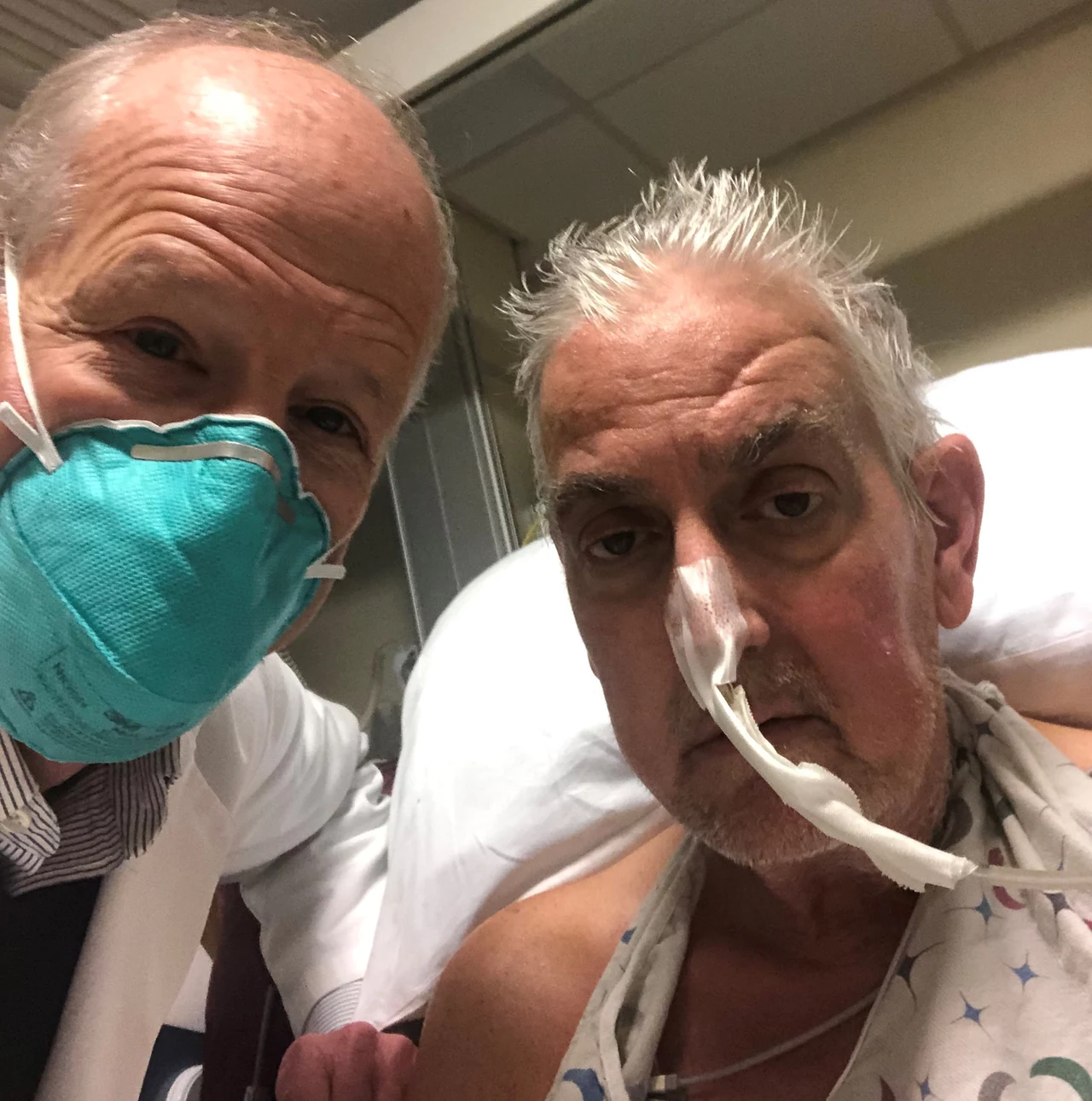
- Wybór był prosty: spróbować albo umrzeć. Wiem, że decyzja była ryzykowna, ale tak naprawdę nie miałem wyjścia - musiałem zdecydować się na ten przeszczep - powiedział David Bennett.
Przeszczep świńskiego serca to nadzieja dla transplantologii
Naukowcy już od dawna myślą o wykorzystaniu zwierzęcych narządów do przeszczepów u ludzi, ale do tej pory nie było to technicznie możliwe. W XIX wieku rany u ludzi leczono przeszczepami skóry od różnych zwierząt - najczęściej żab. W latach 60. ubiegłego wieku, 13 osób otrzymało nerki od szympansów - większość zmarła po kilku tygodniach, ale jeden pacjent przeżył dziewięć miesięcy.
Jeszcze bardziej kontrowersyjny eksperyment przeprowadzili lekarze z Loma Linda University Medical Center w Kalifornii. Stephanie Fae Beauclair (nazywana Baby Fae) urodziła się 14 października 1984 r. z zespołem hipoplazji lewego serca (HLHS), rzadką wadą serca, która występuje u mniej niż 0,05 proc. żywo urodzonych dzieci. Cechuje się niewykształceniu lewej komory serca i zawsze kończy się śmiercią w ciągu kilku tygodni (czasami nawet w życiu płodowym). W latach 80. nie istniały techniki leczenia HLHS, ale rodzice Baby Fae nie chcieli się poddać. Zespół kierowany przez dr Leonarda Baileya postanowił wszczepić dziewczynce serce pawiana. Zabieg od początku skazywano na porażkę, ale Baby Fae ze zwierzęcym organem przeżyła 21 dni.Po tych niepowodzeniach, środowisko naukowe odwróciło się od ksenotransplantacji. To dlatego, że układ odpornościowy reagował w zbyt silny sposób, by zaakceptować obcą tkankę. Pojawienie się nowych technik edycji DNA (głównie CRISPR/Cas9), doprowadziło do wskrzeszenia przeszczepami organów od innych gatunków. To dlatego, że odpowiedni pod względem wielkości i funkcji narząd można genetycznie dopasować do naszego organizmu. Udało się już m.in. przeszczepić świńską nerkę, choć to akurat był eksperyment przeprowadzony na ludzkich zwłokach. W przypadku Davida Bennetta sytuacja była odmienna, chociaż sama procedura budzi poważne wątpliwości natury etycznej. Dlaczego?
Ksenotransplantacji nie przeprowadzono w ramach formalnego badania klinicznego, co jest warunkiem niezbędnym w przypadku eksperymentalnych metod leczenia. Zupełnie nowe są także leki immunosupresyjne podawane pacjentowi - wcześniej takich nie testowano nawet nie na ludziach, co na naczelnych. Obrońcy praw zwierząt potępili przeprowadzoną operację jako niebezpieczną i nieetyczną. PETA zwróciła (słuszną) uwagę na możliwość przenoszenia podczas ksenotransplantacji wirusów zwierzęcych na ludzi. Z drugiej strony jednak, w przypadku Davida Bennetta, nie było czasu na inną reakcję. Niewydolność serca u pacjenta była tak zaawansowana, że lekarze nie dawali mu wysokich szans na przeżycie.
Serce zmodyfikowane genetycznie
Serce, które otrzymał Bennett, pochodziło od świni wyhodowanej przez Revivicor, firmę biotechnologiczną wywodzącą się z PPL Therapeutics, twórców słynnej owcy Dolly. W grudniu, firma Revivicor otrzymała zgodę Amerykańskiej Agencji Żywności i Leków (FDA) na użycie świń GalSafe, które zostały genetycznie zmodyfikowane, aby nie produkować cukru, który powoduje odrzucenie przeszczepu u ludzi. Genetycy wprowadzili niewiele, bo zaledwie ok. 10 zmian w materiale genetycznym - nie ujawniono jednak, jakiej techniki edycji genów użyto.
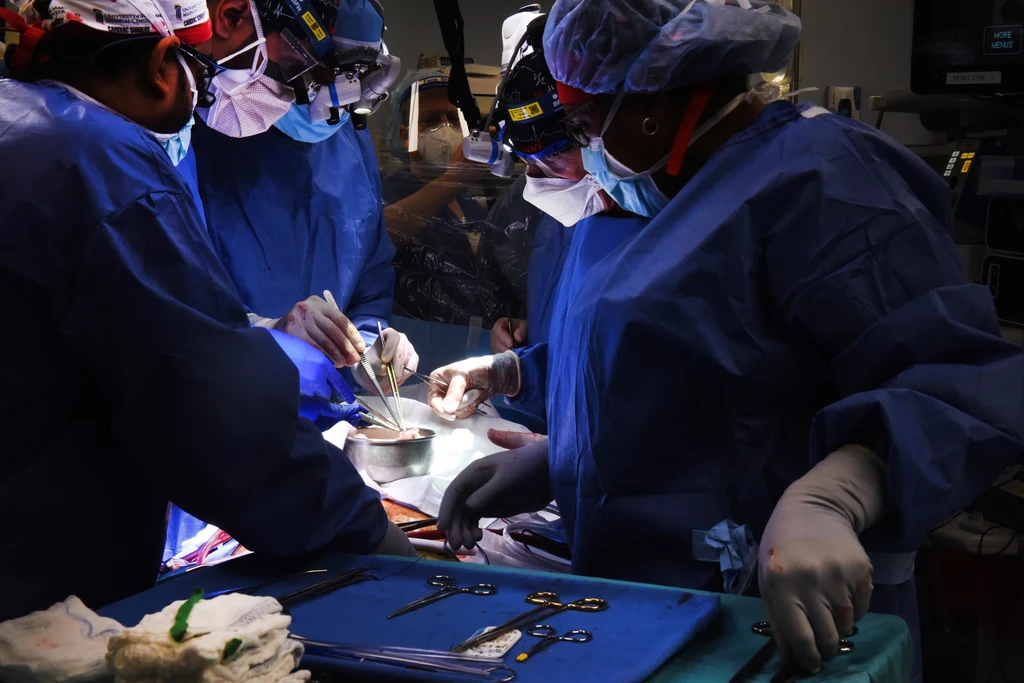
Zwierzę pochodzące z hodowli Revivicor zostało załadowane do furgonetki i przewiezione na północny-wschód od University of Maryland Medical Center. Kilka godzin przed rozpoczęciem operacji, chirurdzy usunęli serce ze świni i umieścili je w maszynie perfuzyjnej, która stale natleniała organ, aby utrzymać go w dobrej kondycji do przeszczepu. Zespołem chirurgów kierował dr Bartley Griffith, który umieścił świński organ w otwartej klatce piersiowej Davida Bennetta.57-letni mężczyzna przez ponad miesiąc był w szpitalu, podtrzymywany przy życiu przez maszynę. Jego stan był zbyt ciężki, by przeprowadzić przeszczep ludzkiego serca lub podłączenie do maszyny sztucznie wspomagającej pracę komór. W grudniu ubiegłego roku Griffith skontaktował się z FDA, aby uzyskać pozwolenie na wykorzystanie świńskiego serca Revivicor. Amerykańska agencja zezwoliła na przeprowadzenie procedury, podobnie jak użycie eksperymentalnego leku zapobiegającego odrzuceniu przeszczepu, wyprodukowanego przez Kiniksa Pharmaceuticals. Wszystkie niezbędne zgody (w tym najważniejsza - pacjenta) zostały podpisane na czas. To był podstawowy warunek, który musiał być spełniony, aby etycznie dopuszczalne było przeprowadzenie przeszczepu.
Warto zastanowić się, co zrobią lekarze, kiedy w ciągu najbliższych tygodni okaże się, że przeszczepione świńskie serce przestanie działać? Różne opcje są brane pod uwagę. W 1982 r., kiedy Barney Clark otrzymał pierwsze sztuczne serce, nie było takich wątpliwości. Clark umierał powoli, w męczarniach, wstrząsany konwulsjami i niewydolnością nerek. Bioetycy podkreślają, że dzisiaj coś takiego nie może mieć miejsca.David Bennett został poinformowany o ryzyku i tym, że nie ma gwarancji sukcesu. Nie wiadomo, ile będzie żył Bennett z przeszczepionym świńskim sercem. Przez kilka tygodni, a nawet miesięcy, będzie monitorowany w szpitalu, zanim nie zostanie wysłany na rehabilitację. Na razie jednak nikt nie wybiega tak daleko w przyszłość.
Serce świni przeszczepione człowiekowi. Co będzie dalej?
Ksenotransplantacja zmodyfikowanego genetycznie świńskiego serca da naukowcom więcej informacji co do dalszych działań. Długoterminowe konsekwencje są jednak nieznane. Odrzucenie narządu może nastąpić dosłownie w każdym momencie.- Odrzucenie narządu jest największym ryzykiem dla Bennetta, ale istnieje również ryzyko związane z lekami stosowanymi do tłumienia układu odpornościowego, aby zapobiec odrzuceniu przeszczepu. Intensywność wymaganego tłumienia układu odpornościowego jest wyższa w przypadku ksenotransplantacji niż w przypadku tradycyjnej transplantacji od ludzkiego dawcy - podsumował dr Griffith.Co dalej? Ksenotransplantacje to wciąż ziemia nieznana - minie jeszcze sporo czasu zanim stanie się realną alternatywą terapeutyczną.