Jak wykorzystać mapę genomu do walki z rakiem?
Nowotwór nie zawsze oznacza wyrok śmierci. Ale statystyki są bezwzględne. Co roku w Polsce rak zabija około 100 000 ludzi. Jest jednak pomysł, który może ją zmniejszyć - wystarczy, aby w niedalekiej przyszłości każdy człowiek miał prawo do taniej diagnostyki antynowotworowej.
Postęp medycyny sprawił, że współczesna onkologia bardzo dobrze radzi sobie z niektórymi typami nowotworów. Często jednak wielu pacjentów umiera "na własne życzenie", bo nie odżywia się odpowiednio, nie bada regularnie i lekceważy pierwsze symptomy choroby.
Podczas Intel Developer Forum 2013, czyli forum technologicznego zorganizowanego w San Francisco przez Intela, można było nie tylko usłyszeć o planach procesorowego giganta dotyczących ekspansji segmentu urządzeń mobilnych, ale także o badaniach nad rakiem oraz mapowaniem genomu człowieka.
Łazarz z Doliny Krzemowej
Intel inwestuje w edukację i rozwój nauki. To fakt. W rozmowie z Thomasem Kilroy'em - wiceprezesem marketingu i sprzedaży w Intelu - usłyszeliśmy, jak ważna dla firmy jest szeroko rozumiana nauka. Bez odkryć w sterylnych laboratoriach nie byłoby nowych technologii, a co za tym idzie - innowacyjnych laptopów, tabletów i smartfonów. Ale nie byłoby też lekarstwa na raka, które jest uważane za Świętego Graala medycyny.
Mało kto wierzy, że pewnego dnia taki medykament uda się opracować, ale dzięki staraniom naukowców różnych dziedzin jesteśmy znowu o krok bliżej upragnionego celu.

Gigant z Santa Clara ma już na koncie pierwszego wyleczonego pacjenta. Pośrednio. Jest nim Eric Dishman, jeden z pracowników, u którego przed 26 laty zdiagnozowano raka nerek. Lekarze nie dawali Dishmanowi dużych szans na przeżycie, nie mówiąc już nawet o pełnym wyleczeniu. Ten jednak się nie poddał, choć podjęta terapia kompletnie wyniszczyła jego organizm.
Standardowe metody leczenia przynosiły kiepskie rezultaty i wtedy Intel zaproponował "coś" mniej konwencjonalnego - stworzenie kompletnej mapy genomu i opracowanie spersonalizowanej terapii antynowotworowej.
- Zgodziłem się na terapię. Po długiej i męczącej walce z chorobą nie miałem nic do stracenia. Po kilku miesiącach zaproszono mnie do gabinetu lekarskiego, w którym poza mną nie było nikogo, tylko kilka wygaszonych monitorów. Pielęgniarz je włączył i po chwili brałem udział w rozbudowanej konferencji przez Skype'a. Tak wygląda nowoczesna medycyna - powiedział Dishman do ponad 5 tys. dziennikarzy podczas swojego wystąpienia na IDF 2013.
Wtedy, podczas wideokonferencji lekarze powiedzieli Ericowi, że po jego raku nie ma najmniejszego śladu. Stworzona z wykorzystaniem superkomputerów Intela terapia antynowotworowa, oparta na mapie genomu pacjenta, przyniosła pożądany skutek.
Wspomniana mapa genomu okazała się niczym innym jak zsekwencjonowanym DNA z zaznaczonymi miejscami, w których doszło do mutacji mogących wywołać nowotwór. Co ciekawe, podczas konsultacji specjaliści nie wzywali Dishmana do siebie osobiście, a jedynie analizowali wyniki jego badań i zlecali właściwą terapię. Nie byłoby to możliwe, gdyby nie najnowocześniejsze technologie, które zaprzęgnięto do walki z nowotworami.
Portret zabójcy
Dlaczego u jednego pacjenta nowotwór reaguje na lek, podczas gdy u innego nie? Dlaczego występują nawroty raka, odporne na leczenie, które było wcześniej przeprowadzone? Odpowiedzi na te pytania mogą przynieść portrety genomowe nowotworów. Zakłada się, że przy każdym zdiagnozowaniu choroby nowotworowej u pacjenta byłaby tworzona taka mapa genomowa i przygotowywana odpowiednia terapia.
Pierwsze, zakrojone na szeroką skalę badania z mapami genomowymi nowotworów przeprowadzono na szpiczaku mnogim, czyli nieuleczalnym nowotworze krwi. Wykształca się on, gdy komórki osocza mutują i dzielą się w sposób niekontrolowany, osadzając się w szpiku kostnym. Nowotwór ten charakteryzuje się klonalną proliferacją atypowych plazmocytów, produkujących monoklonalną immunoglobulinę.
Plazmocyty to komórki układu odpornościowego, które tworzą i wydzielają do organizmu przeciwciała (immunoglobuliny) biorące udział w walce z patogenami. W przypadku ataku szpiczaka mnogiego nowotwór ten przeprogramowuje plazmocyty, by te "służyły" jego celom.
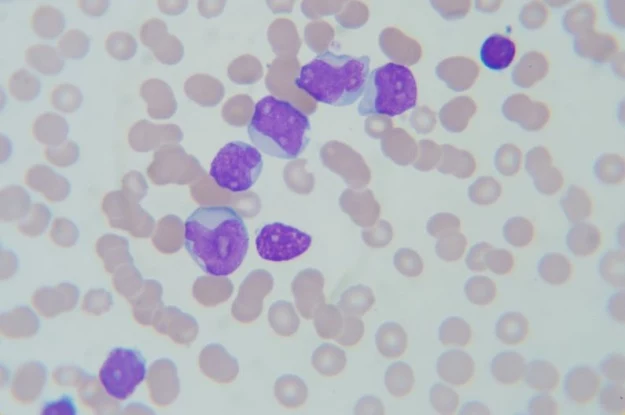
Szpiczak niekorzystnie reaguje na wstępne leczenie, po którym zazwyczaj następuje nawrót choroby w postaci nowych ognisk nowotworu. Są one wysoce odporne na leki, co dla chorego praktycznie oznacza śmierć. Co roku w Europie szpiczaka mnogiego wykrywa się u niemal 22 tys. osób. Większość przegrywa z chorobą w ciągu 2 lat od chwili postawienia diagnozy.
Projekt Multiple Myeloma Genomic Initiative pozwolił stworzyć mapę genomu szpiczaka mnogiego. Odkryto jednocześnie geny, które występują w tym nowotworze, a także obszary genetyczne, w których dochodzi do mutacji. Analiza otrzymanej sekwencji stworzyła bezprecedensową możliwość stworzenia terapii skierowanej stricte na szpiczaka.
- Mutacje występujące w przypadku szpiczaka mnogiego przebiegają ograniczoną liczbą ścieżek. Pokazuje to wartość dogłębnego spojrzenia nie tylko na tej jeden nowotwór - powiedział Todd Golub z Dana-Farber Cancer Institute, który koordynował badania.
Narzędzia stworzone przez międzynarodowy zespół naukowców umożliwiły spojrzenie na szpiczaka mnogiego w wysokiej rozdzielczości. Dzięki temu można znaleźć geny, których mutacje występują częściej niż przewiduje prawdopodobieństwo. Odkryto też mechanizmy, które mogą być celem terapii.
Sporą niespodzianką dla naukowców było odkrycie mutacji kinazy białkowej serynowo-treoninowej B-Raf (oraz związanego z nią genu B-Raf). Onkolodzy wiedzieli, że występuje ona w przypadku czerniaka i raka okrężnicy, ale nie łączono jej wcześniej ze szpiczakiem mnogim.
- Do tej pory w rozważaniach nad nowotworami nie braliśmy pod uwagę genów, które często mutują. Ustalenie, czy będą one dobrym celem terapii genomowej, wymaga wielu dodatkowych badań. Niemniej jednak jest to przykład wykorzystania map genomowych do terapii antynowotworowych - wyjaśnił Golub.
Mimo że pierwsze mapy genomowe opracowano dla szpiczaka mnogiego, to nic nie stoi na przeszkodzie, by mechanizm ten zastosować w przypadku innego typu nowotworów. Czerniak, chłoniak i glejak to tylko nieliczne z rodzajów, których portret genetyczny udało się opracować.
Mapa genomu za 350 zł
Intel chce zapewnić skuteczniejszą walkę z nowotworami dzięki tworzeniu zaawansowanych map genomowych. Obecna na IDF 2013 prezes Intela, Renee James, podkreśliła, że prace nad superkomputerami mogą zmienić oblicze służby zdrowia. Gigant z Santa Clara już współpracuje z Knight Cancer Institute z Oregon Health and Science University nad stworzeniem wielowymiarowej mapy DNA człowieka z opcją przeszukiwania czułych punktów.
Problem jest taki, że nie da się stworzyć uniwersalnej mapy genomu. Dla każdego pacjenta portret genomowy musi być tworzony indywidualnie. To z kolei wymaga sporych nakładów czasowych i finansowych. Ale Intel wierzy, że w najbliższych latach uda się proces ten wprowadzić na rynek komercyjny i zamknąć w cenie 100 dol.
- Chcemy wyjść z leczeniem ze szpitali. Po raz pierwszy w historii współczesnej medycyny technologiczne aspekty służby zdrowia są tak samo ważne jak te biologiczne. Im więcej mocy obliczeniowej możemy zaoferować za rozsądną cenę, tym więcej żyć można ocalić - powiedziała Renee James.
Ile w tym wszystkim prawdy, a ile czczych obietnic? Nie ulega wątpliwości, że inicjatywa Intela budzi respekt. Oto bowiem producent procesorów, z zamkniętej dla przeciętnych obywateli społeczności, wychodzi naprzeciw wyzwaniom współczesnej medycyny. Walka z rakiem pod każdą postacią to szczytna idea, dlatego trzymamy kciuki za Intela z całych sił.